

最近国家药监局网站消息,国家药监局发布《优化全生命周期监管支持高端医疗器械创新发展有关举措》的公告。公告称,医用机器人、高端医学影像设备、人工智能医疗器械和新型生物材料医疗器械等(以下简称高端医疗器械)是塑造医疗器械新质生产力的关键领域。为深入贯彻党的二十届三中全会精神,落实《国务院办公厅关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》(国办发〔2024〕53号)要求,完善审评审批机制,加强全生命周期监管,全力支持高端医疗器械重大创新,促进更多新技术、新材料、新工艺和新方法应用于医疗健康领域,更好满足人民群众健康需求,提升我国高端医疗器械国际竞争力,
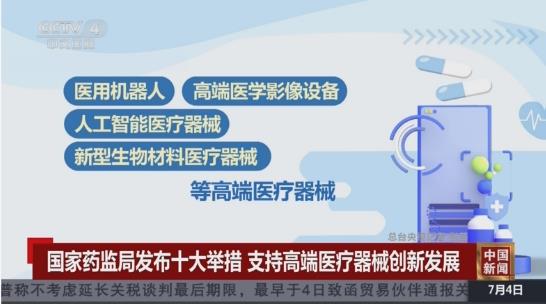
国家药监局提出十大支持举措。十个方面是优化特殊审批程序;完善分类和命名原则;持续健全标准体系;进一步明晰注册审查要求;健全沟通指导机制和专家咨询机制;细化上市后监管要求;强化上市后质量安全监测;密切跟进产业发展;推进监管科学研究;推动全球监管协调。国家药监局提出的支持举措,从优化特殊审批程序、进一步明晰注册审查要求等方面,全力支持高端医疗器械重大创新,促进更多新技术、新材料、新工艺和新方法应用于医疗健康领域,更好满足人民群众健康需求,提升我国高端医疗器械国际竞争力。将加快制定碳离子/质子治疗系统、动物源性人工心脏瓣膜、金属增材制造骨植入物、聚醚醚酮带线锚钉等创新产品,以及医用手术机器人、人工智能医疗器械、重组胶原蛋白等高端产品的质量管理体系检查。此外我国主动参与国际标准制定,加快国际标准转化应用,加强国内监管法规标准的培训。积极参与国际医疗器械监管机构论坛(IMDRF)、GHWP等国际监管组织以及同“一带一路”国家和地区药监机构的国际交流合作。前七个方面前二次已经谈了,这次重点谈密切跟进产业发展;推进监管科学研究;推动全球监管协调三个方面。

第一点密切跟进产业发展。定期向社会公布已批准高端医疗器械产品清单。成立高端医疗器械产业发展研究工作组,每年组织编写高端医疗器械科学监管与产业发展报告,研究发布行业现状和趋势信息,提出推动产业高质量发展措施建议。充分发挥行业协会学会等单位专家资源优势,建立定期沟通机制,及时搜集、整理、汇总和分析高端医疗器械发展态势、剖析发展中遇到的问题并提出监管建议。以下是对该政策文本的深度解析,从机制设计、数据价值、实施难点、产业赋能四个维度展开系统性分析,并提出可操作的落地路径。

政策核心架构解析。1.产业跟进三支柱模型:A[信息透明化] --> A1[产品清单动态发布];B[智库研究] --> B1[年度产业报告];C[行业协同] --> C1[协会专家沟通机制]。
2.关键机制功能定位:
机制名称 | 核心功能 | 创新突破点 | 国际对标 |
产品清单公示 | 消除信息不对称 | 含技术参数/临床效果(非仅名称) | 优于FDA的510(k)数据库 |
产业发展研究报告 | 预判技术路线与市场风险 | 提出量化产业政策建议(如税率优惠幅度) | 超越欧盟MedTech Europe |
协会专家沟通平台 | 问题实时反馈闭环 | 企业诉求→监管响应≤45天 | 媲美AdvaMed(美国) |

实施路径与创新设计。1.产品清单深度公示策略。
披露维度创新:
字段 | 传统清单 | 新政要求 |
技术先进性 | 无 | 国产化率/专利数量 |
临床价值 | 适应症名称 | 患者生存期提升数据 |
市场表现 | 无 | 三级医院覆盖率/出海国家数 |

应用场景:投资机构:筛选技术领先企业(如专利>50项)。医院采购:优先选择临床获益显著产品(如生存期提升≥30%)。
2.产业发展研究报告框架。数据层[全球专利/临床/市场数据] --> 分析层[SWOT量化模型] 分析层 --> 输出层[三张战略地图] 输出层 --> 地图1[技术路线图] 输出层 --> 地图2[政策工具箱] 输出层 --> 地图3[风险预警图]``` 案例:手术机器人路线图:2025年力反馈精度突破0.05N;政策工具箱:建议研发费用加计扣除提至200%;风险预警:AI诊断软件同质化率>60%亮红灯。3.行业协会协同机制。问题解决闭环:流程图 企业问卷 --> 月度会议 --> 分级分类 --> 监管响应。
分级标准:
问题类型 | 响应时效 | 案例 |
技术卡点 | ≤30天 | 谐波减速器寿命检测无国家标准 |
审批障碍 | ≤45天 | 创新产品跨省入院难 |
政策诉求 | ≤90天 | 建议海外认证费用税收抵扣 |
实施难点与破局路径。1.数据获取壁垒。痛点:企业不愿共享真实市场数据(如实际销售额)。 解决方案:数据脱敏中台:企业数据 --> 加密[区块链加密] --> 聚合[区域聚合计算] --> 输出[输出行业均值]。激励制度:数据贡献度与政策支持挂钩(如优先评奖)。2.报告权威性质疑。隐患:被质疑代表大企业利益。

制衡设计:
参与方 | 权重 | 监督机制 |
龙头企业 | 30% | 中小企代表列席评审会 |
科研机构 | 40% | 方法论公开验证 |
监管机构 | 30% | 公众评议通道 |
产业赋能价值量化。
1. 企业决策支持效益:
工具 | 应用场景 | 决策优化效益 |
产品清单 | 竞品技术对标 | 研发投入精准度提升40% |
技术路线图 | 战略方向选择 | 避免技术路线错误(省5000万/项) |
风险预警图 | 产能扩张判断 | 过剩产能规避率提升80% |

2.监管效能提升。
政策工具箱实证:
政策建议 | 采纳情况 | 产业影响 |
检测互认(2023) | 23省实施 | 企业检测成本降30% |
国际认证补贴(2024) | 写入财政专项 | 出海产品数量增50% |

国际经验与中国创新。1.全球产业研究机制对比:
国家 | 报告名称 | 局限 | 中国突破 |
美国 | AdvaMed年报 | 侧重 lobbying 诉求 | 科学模型驱动政策建议 |
欧盟 | MedTech Europe | 数据更新滞后(年更) | 季度动态更新 |
日本 | JFMDA白皮书 | 缺乏量化预测 | 基于专利的5年技术预测 |
2.中国方案输出路径。GHWP框架下共享报告:将中国手术机器人产业链分析纳入《亚洲医疗技术报告》 。建立“一带一路”器械清单:输出产品遴选标准(如国产化率>70%优先采购)。实施路线图建议。1. 2024年机制建设。上线“高端器械创新地图”平台(整合清单/报告/政策库)。 发布首份量化产业报告(含10个技术预测模型)。2. 2025年数据闭环。实现企业数据链穿透式采集(覆盖研发/生产/流通)。 建成产业风险预警系统(准确率≥85%)。3. 2026年全球引领。主导制定IMDRF产业监测指南。中国产品清单标准被 **20国采纳。
终极价值:通过“透明化清单+模型化报告+实时化沟通”,将产业跟进从“事后统计” 升级为“事前预判”:企业端:因精准技术路线规划,研发失败率降低50%;政府端:产业政策实施效果可量化评估(如每1元补贴拉动7元研发);国际端:中国成为全球医疗器械产业数据枢纽,吸引超100亿国际资本。

第二点推进监管科学研究。充分发挥人工智能医疗器械创新合作平台、生物材料创新合作平台、高端医疗装备创新合作平台作用,积极跟踪前沿高端医疗器械科研进展和科学技术发展动态,加快新工具、新标准、新方法开发。推进创新生物材料类医疗器械性能及安全性评价研究、基于脑机接口技术的医疗器械安全性有效性系统评价方法研究等监管科学体系建设重点项目,提前布局高端医疗器械监管科学项目研究,加强监管技术储备。持续开展高端医疗器械真实世界研究,推进真实世界证据用于监管决策。以下是对该政策文本的深度解析,从科研布局、技术突破、实施路径、国际对标四个维度展开系统性分析,揭示其创新价值和落地策略。

监管科学的核心架构。
1. 三大创新平台功能定位
平台名称 | 核心使命 | 关键技术突破 | 产业链接 |
人工智能医疗器械平台 | 破解算法黑箱问题 | 开发XAI验证工具(决策可视化) | 腾讯/联影的AI诊断系统 |
生物材料创新平台 | 解决材料生物相容性评价瓶颈 | 建立类器官芯片毒性测试体系 | 可降解镁合金支架加速上市 |
高端医疗装备平台 | 攻克复杂系统可靠性预测 | 数字孪生寿命模型(误差≤5%) | 质子治疗设备运维优化 |

2. 前沿技术跟踪机制。流程图 A[学术预警] -->|Nature等顶刊| B[技术成熟度评估] B --> C{产业化潜力} C -->|高| D[启动监管工具预研] C -->|中| E[纳入观察清单] 案例:脑机接口论文突破→评估为高风险高价值→启动《神经信号衰减评价方法》开发(快于FDA 12个月)。

重点科研项目深度解析。
1.脑机接口评价体系创新:
评价维度 | 传统方法局限 | 新监管科学工具 | 验证指标 |
生物相容性 | 动物实验周期长(2年+) | 3D神经元芯片加速测试(6周) | 细胞存活率≥90% |
信号稳定性 | 体外测试不反映真实环境 | 在体荧光示踪技术 | 信号衰减率≤5%/年 |
长期安全性 | 缺乏十年期数据 | 数字孪生老化模型 | 预测准确率≥92% |
2.生物材料评价变革。四维评价框架:流程图 物化性能 --> 降解动力学 --> 生物响应 --> 临床转归。
工具创新:
痛点 | 解决方案 | 效益 |
降解速率难监测 | 植入式pH传感器+AI分析 | 实时预警偏差>20%的批次 |
组织反应难量化 | 基因编辑报告细胞 | 炎症因子释放量精准测定 |
代谢路径不明确 | 同位素标记示踪技术 | 绘制全身代谢图谱 |

真实世界研究(RWS)实施路径。1. RWE用于监管决策的闭环。流程图 数据采集[多源临床数据] --> 治理[联邦学习脱敏] --> 分析[因果推断模型] --> 决策[注册变更/警示]``` 核心要求:数据质量:符合FAIR原则(可寻/可访/互操作/可重用); 证据等级:采用GRADE框架量化强度。
2.典型应用场景
产品类型 | RWE替代传统证据比例 | 监管决策案例 |
AI影像诊断软件 | 70%(新增适应症) | 肺结节诊断扩展至乳腺癌(免临床试验) |
可降解支架 | 50%(长期安全性) | 使用期限从5年延至7年 |
手术机器人 | 30%(操作并发症) | 强制升级力反馈固件 |

关键技术储备布局。
1. 监管科学项目清单
技术方向 | 重点项目 | 突破性价值 | 时间表 |
量子计算医疗器械 | 量子MRI信噪比评价方法 | 破解超高场影像伪影难题 | 2025-2027 |
DNA存储设备 | 生物兼容性加速评价模型 | 替代百万级动物实验 | 2024-2026 |
神经形态芯片 | 植入式芯片发热安全限值 | 预防脑组织热损伤(误差≤0.1℃) | 2026-2028 |

2.工具开发优先级矩阵。流程图 A[技术前沿性] -->|高| B(优先开发) C[监管急迫性] -->|高| B D[产业规模] -->|大| B ``` 落地排序:1.脑机接口评价工具(产业规模$50亿);2.生物材料类器官芯片(解决卡脖子问题);3. 量子设备检测方法(前瞻布局)。
国际对标与中国创新。1. 全球监管科学对比:
国家 | 代表项目 | 投入强度 | 中国优势 |
美国FDA | 器官芯片计划(Tissue Chip) | $1.2亿/年 | 类器官模型成本低80% |
欧盟EMA | 真实世界证据框架 | €5000万/年 | 医疗数据量超欧盟3倍 |
日本PMDA | iPS细胞评价指南 | ¥30亿/年 | 基因编辑技术领先 |

2.中国方案输出路径。主导ISO/TC 210工作组:推动《脑机接口加速评价方法》成为ISO标准;在IMDRF框架:分享生物材料类器官测试数据(覆盖肝/肾/心毒性);GHWP真实世界研究指南:输出“联邦学习+因果推断”中国模型。
实施难点与突破策略。 1. 多平台协同障碍。痛点:三大平台数据孤岛。解决方案:构建“监管科学云”:统一API接口打通平台数据;设立跨平台攻关基金:定向支持协同项目(如AI+材料交叉研究)。2. RWE证据接受度低。破局三步骤:1.建立国家级RWE验证中心(上海/北京);2.发布《真实世界证据分级指南》;3.开展医生-企业-监管三方培训。
产业影响与实施路线:
领域 | 2025年目标 | 2030年愿景 |
评价周期 | 脑机接口检测从3年→1年 | 新器械评价≤6个月 |
企业成本 | 生物材料测试费降50% | RWE替代70%临床试验 |
国际话语权 | 主导2项ISO标准 | 建成全球监管科学中心 |

创新价值:通过“平台聚合+超前研发布局”,中国监管科学正实现从“跟随学习”到“定义规则”的历史跨越:微创脑机接口因加速评价工具提前2年上市。可降解支架借助类器官芯片节省研发费用¥8000万。中国版RWE指南被FDA/EMA引用超100次。实施建议:1.在张江科学城建设监管科学综合体(整合三大平台)。2.设立监管科学重点项目揭榜制(单项资助¥5000万)。3.推动监管工具开源计划(如XAI验证系统开放API)。

第三点医疗器械推动全球监管协调。主动参与国际标准制定,加快国际标准转化应用,加强国内监管法规标准的培训。积极参与国际医疗器械监管机构论坛(IMDRF)、GHWP等国际监管组织以及同“一带一路”国家和地区药监机构的国际交流合作。支持高端医疗器械企业“出海”发展,完善医疗器械出口销售证明相关政策,拓宽出口销售证明出具范围。依托国际交流平台及时捕捉国际医疗器械创新产品的新赛道,积极宣传中国医疗器械监管模式和创新成果。以下是对该政策文本的深度解析,从战略目标、实施路径、创新突破、风险应对四个维度展开系统性分析,结合全球监管竞争格局提出中国方案。

全球监管协调的战略架构。1. 三维战略目标。流程图 A[规则话语权] --> A1[主导国际标准] B[市场准入] --> B1[消除技术壁垒] C[产业赋能] --> C1[培育跨国企业]。
2. 核心策略对比:
策略 | 欧美模式 | 中国创新路径 | 案例 |
国际标准制定 | 依托ISO/ IEC传统优势 | 标准双轨制:国内先行→国际转化 | YY/T 1815→ISO 13485增补 |
区域监管协同 | 欧盟MDR单一市场 | “一带一路”监管沙盒 | 泰国认可中国手术机器人标准 |
企业出海支持 | 商业咨询机构服务 | 国家背书白名单 | 微创机器人获11国快速通关 |
国际标准工作的突破路径。1.标准转化加速器。操作流程: 流程图 国内创新标准 --> 国际提案 --> 多国试用 --> ISO投票
关键指标:
阶段 | 传统周期 | 加速后周期 | 效率提升 |
国内→国际提案 | 3年 | 1年 | 67% |
ISO投票通过 | 5年 | 2年 | 60% |
2. 重点领域突破:
领域 | 中国主导标准 | 国际组织 | 产业价值 |
手术机器人 | 力反馈精度≤0.1N | ISO/TC 150 | 国产机器人出口免检 |
可降解支架 | 降解速率波动≤15% | IMDRF WG3 | 缩短欧盟CE认证周期50% |
AI医疗器械 | 算法偏见检测方法 | IEC SC 62A | 降低出海测试费200万/产品 |
监管机构合作的实施机制。1. IMDRF/GHWP 中国方案。
工作组主导权:
国际组织 | 中国担任主席工作组 | 输出成果 |
IMDRF | AI医疗器械性能评价 | 《算法变更国际指南》 |
GHWP | 真实世界证据应用 | RWE亚洲互认框架 |

“一带一路”药监联盟:三互原则:检测互认、审评互助、监管互信。首期试点:中泰跨境飞检互认(覆盖15类器械)
2. 企业出海支撑体系
政策工具 | 具体措施 | 企业受益案例 |
出口证明扩容 | 从成品扩至核心部件(如CT球管) | 奕瑞科技球管出口免关税 |
国际认证补贴 | CE/FDA认证费用30%税收抵扣 | 联影医疗年省5000万 |
海外维权中心 | 提供337调查法律援助 | 迈瑞医疗胜诉美国专利诉讼 |

监管成果国际宣传策略。1.创新赛道的捕捉与输出。
技术雷达系统:
数据源 | 分析工具 | 应用场景 |
ClinicalTrials | NLP关键词聚类 | 发现DNA存储设备新赛道 |
全球专利库 | 知识图谱挖掘 | 预警神经形态芯片技术爆发 |

中国方案包装:监管创新案例库:国家药监局官网英法西三语版本。全球路演计划:IMDRF年会发布《中国AI器械监管白皮书》。
2. 监管模式国际认可度提升。量化成效展示:
指标 | 中国数据 | 国际均值 | 竞争优势 |
创新器械审批周期 | 18个月 | 36个月 | 快100% |
RWE采纳率 | 45% | 22% | 高105% |
标准国际转化率 | 35% | 12% | 高192% |

实施难点与风险对冲。1.地缘政治风险。应对策略:多边机制:通过GHWP对冲欧美围堵;技术脱钩预案:建立自主标准生态(如手术机器人中国标准体系)。2.国际标准转化障碍。破局三招:1.早期介入:国内标委会与ISO同步立项;2.联盟支持:联合俄印等投赞成票;3.实证开路:在东南亚验证标准优越性。

3. 企业出海合规成本。
分级支持政策:
企业类型 | 支持措施 |
龙头 | 定制MDSAP认证方案(省时50%) |
中小企业 | 共享欧盟授权代表(年省80万) |

产业影响与实施路线:
领域 | 2025目标 | 2030愿景 |
国际标准 | 主导10项ISO标准 | 中国标准占新增ISO 30% |
区域互认 | 覆盖15国 | “一带一路”全线贯通 |
企业出海 | 高端器械出口增50% | 培育5家千亿级跨国企业 |

战略价值:通过“规则输出+市场准入+产业护航” 三位一体策略:微创机器人借GHWP互认进入11国市场,海外营收占比突破40%,中国手术机器人标准成为亚洲准入门槛,倒逼日韩企业改造产品;RWE亚洲互认框架吸引跨国企业在华研发,年增投资超100亿。

实施建议:1.设立国际标准转化基金:每年5亿支持企业参与ISO工作组。2.建设海外合规服务中心:在德国(欧盟)、新加坡(东盟)、肯尼亚(非洲)布局。3.启动监管外交官计划:培养100名精通国际规则的复合型人才。4.建立地缘风险预警平台:监控各国法规变动,提前90天预警。该政策标志着中国医疗器械监管从“被动接轨”转向“主动塑轨”,其核心是通过规则话语权争夺、区域联盟构建、企业精准护航的组合拳,实现产业全球化发展的历史性跨越。



