

今天国家药监局网站消息,国家药监局发布《优化全生命周期监管支持高端医疗器械创新发展有关举措》的公告。公告称,医用机器人、高端医学影像设备、人工智能医疗器械和新型生物材料医疗器械等(以下简称高端医疗器械)是塑造医疗器械新质生产力的关键领域。为深入贯彻党的二十届三中全会精神,落实《国务院办公厅关于全面深化药品医疗器械监管改革促进医药产业高质量发展的意见》(国办发〔2024〕53号)要求,完善审评审批机制,加强全生命周期监管,全力支持高端医疗器械重大创新,促进更多新技术、新材料、新工艺和新方法应用于医疗健康领域,更好满足人民群众健康需求,提升我国高端医疗器械国际竞争力,

国家药监局提出十大支持举措。十个方面是优化特殊审批程序;完善分类和命名原则;持续健全标准体系;进一步明晰注册审查要求;健全沟通指导机制和专家咨询机制;细化上市后监管要求;强化上市后质量安全监测;密切跟进产业发展;推进监管科学研究;推动全球监管协调。国家药监局提出的支持举措,从优化特殊审批程序、进一步明晰注册审查要求等方面,全力支持高端医疗器械重大创新,促进更多新技术、新材料、新工艺和新方法应用于医疗健康领域,更好满足人民群众健康需求,提升我国高端医疗器械国际竞争力。将加快制定碳离子/质子治疗系统、动物源性人工心脏瓣膜、金属增材制造骨植入物、聚醚醚酮带线锚钉等创新产品,以及医用手术机器人、人工智能医疗器械、重组胶原蛋白等高端产品的质量管理体系检查。此外我国主动参与国际标准制定,加快国际标准转化应用,加强国内监管法规标准的培训。积极参与国际医疗器械监管机构论坛(IMDRF)、GHWP等国际监管组织以及同“一带一路”国家和地区药监机构的国际交流合作

我将再次从几点根据自己的认知来交流。第一点医疗器械需要优化特殊审批程序。对该政策文本的深度解析,从制度设计、实施难点、创新突破、产业影响四个维度进行系统性拆解,并提出优化路径建议:政策核心要点解析。1.创新审查机制升级。适用对象:国内首创+国际领先+显著临床价值(三重门槛)。案例:脑机接口神经刺激器、自进化AI诊断系统。优化方向:建立“双轨沟通机制”:预研期(Pre-Sub):审查专家提前介入研发方案;注册期:开通24小时问题响应通道;技术指导清单化管理:发布《高端器械研发注册合规指引》(如手术机器人力反馈精度达标路径)。

2.变更注册程序革新。突破性政策:将变更注册(如AI算法迭代、材料工艺升级)纳入创新审查程序。简易变更:非核心参数调整→年度报告备案(节省6个月)。重大变更:核心算法更新→优先审评(60日内完成)。案例:某AI影像软件优化肺结节分割模型,通过简易变更实现2周内上市。
3.产业政策协同加速
国家计划 | 对接路径 | 代表产品 |
中国制造2025 | 开辟“重大装备绿色通道” | 7T超导MRI |
人工智能三年行动计划 | 建立AI器械检测互认平台 | 病理诊断机器人 |
脑科学计划 | 出台脑机接口专用指导原则 | 植入式神经解码器 |

4.“揭榜挂帅”产品支持。全周期陪跑机制:揭榜 --> 专班[专家专班] --> 预研[研发合规预审] --> 检测[检测资源调配] --> 优先审评。特殊规则适配:生物活性材料:接受类器官测试替代动物实验。脑机接口:允许有限真实世界数据替代部分RCT。
5.附条件批准探索。实施框架:
要素 | 具体要求 | 监管工具 |
适用条件 | 严重危及生命+无替代疗法 | 临床急需目录动态管理 |
证据要求 | 替代终点数据+理论获益大于风险 | 数字孪生疗效预测模型 |
上市后研究 | 3年内完成确证性研究 | UDI全流程追溯+区块链存证 |
退出机制 | 未达预期疗效→强制退市 | 风险收益动态评估算法 |
政策实施难点与对策。1. 创新认定标准模糊。痛点:“国际领先”缺乏量化指标(专利数?临床数据?)。对策:建立技术先进性指数:专利质量分+临床效益分+创新程度分。设置最低阈值:≥80分方可进入创新通道(如脑机接口需突破3项核心技术)。2.变更注册风险控制。隐患:AI算法迭代可能导致诊断偏差。风控方案:算法沙盒测试:强制在数字孪生体运行10万次诊断。变更分级矩阵:
影响维度 | 轻微变更 | 重大变更 |
诊断敏感性 | ±3%内 | >3% |
适用人群 | 不变 | >3% |
3. 附条件批准伦理争议。争议焦点:患者可能成为“临床试验对象”。平衡机制:双重知情同意:常规治疗同意书+研究风险特别告知;疗效保险制度:企业购买专项险,赔付未达预期疗效的损失。

创新突破。1.监管工具升级。数字监管基座:建设器械监管大脑:整合20万产品UDI数据,实时预警风险。开发智能审查助手:自动识别申报资料缺陷(准确率≥92%)。 2. 产融结合创新。保险金融工具:
产品类型 | 保险方案 | 杠杆效应 |
附条件批准器械 | 疗效对赌保险 | 企业付费获保,患者理赔 |
附条件批准器械 | 研发失败险 | 降低企业融资成本40% |

3. 国际规则输出。中国标准国际化:推动“中美创新器械互认通道”:符合中国创新标准即认可基本安全性。在IMDRF框架下主导《脑机接口附条件批准指南》。产业影响量化预测
政策举措 | 短期影响(1-2年) | 长期效益(5年+) |
创新审查优化 | 审评耗时缩减40% | 国产高端器械市占率超50% |
变更注册简化 | 产品迭代速度提升3倍 | 中国企业主导全球标准≥10项 |
脑机接口专项支持 | 5款产品获批上市 | 建成全球最大神经干预市场 |
附条件批准落地 | 10个危重症器械加速上市 | 患者平均生存期延长2.3年 |

优化实施建议。1. 构建“三张清单”。权力清单:明确创新审查专家委员会的终审裁量权边界;风险清单:发布《附条件批准器械退出处置预案》;服务清单:开通“揭榜挂帅”产品检测费补助直通车。2.开展压力测试。在海南博鳌乐城试点脑机接口附条件批准:允许基于6例重症患者数据有条件使用。同步开展真实世界疗效研究。3. 建立容错机制。对创新审查决策实施尽职免责:专家按指南操作且无利益输送→豁免追责。企业如实披露风险→减轻处罚。终极目标:通过特殊审批程序的精准化、敏捷化、国际化改造,推动中国高端医疗器械从“合规上市”向“规则定义”跃迁,最终实现产业竞争力与患者获益的双重提升。
第二点医疗器械完善分类和命名原则。对该政策文本的深度解析,从问题背景、实施路径、创新突破、产业影响四个维度进行系统性拆解,并提出关键行动建议:政策核心目标与痛点。
1.解决三大分类命名乱象
乱象类型 | 典型案例 | 政策应对 |
医用机器人边界模糊 | 骨科导航机器人 vs 手术辅助机械臂 | 制定专用分类指导原则 |
新技术产品属性争议 | 医疗大模型(软件?器械?) | 开展管理属性研究 |
核心部件监管缺失 | 7T MRI超导磁体依赖进口但无单独监管 | 细化核心零部件管理要求 |

2.关键技术挑战。医用机器人分类难点:功能集成度:单功能器械(如持镜机器人) vs 多功能系统(如达芬奇);自主性等级:辅助操作(Class B) vs 自主执行(Class D)。AI产品动态性矛盾:算法持续迭代与传统分类静态管理的冲突。分类命名体系建设路径。1.医用机器人规则框架。流程图A[分类维度] --> A1[操作部位] A --> A2[功能模式] A --> A3[风险等级] B[命名规则] --> B1[技术特征+临床功能] B --> B2[形态标识]。分类实施要点:手术机器人:按侵入性分级(Ⅰ类:体表操作;Ⅱ类:自然腔道;Ⅲ类:侵入组织)。康复机器人:按神经干预深度(A级:运动辅助;B级:神经调控)。命名共识:技术特性+临床功能+器械形态。示例:原名称:“XX牌骨科操作设备” → 新名称:“关节置换光学导航(技术)机械臂系统(形态)”。
2.新技术产品属性判定
产品类型 | 管理属性判定逻辑 | 分类调整机制 |
医疗大模型 | 辅助诊断→按软件管理(Ⅱ类) | 每季度算法评估,精度降幅>5%则升类 |
合成生物材料 | 含活细胞→按组织工程产品(Ⅲ类) | 细胞活性<80%时降为Ⅱ类 |
合成生物材料 | 改变原始数据→按器械管理(Ⅱ类) | 增加“版本追溯”要求 |

3. 核心零部件管理创新。实施策略:
零部件类型 | 监管方式 | 案例应用 |
手术机器人减速器 | 备案制+飞行检查 | 谐波减速器寿命≥10万小时 |
MRI超导磁体 | 唯一编码+性能年检 | 7T磁体磁场均匀性≤5ppm |
AI芯片 | 算法固件锁定+变更审查 | 深度学习算力≥10 TOPS |
动态调整机制的创新设计。1.技术成熟度评估模型。2.触发式调整流程。
产业影响与实施难点。1. 企业合规成本变化
政策要素 | 成本增加项 | 成本降低项 |
核心零部件管理 | 编码系统改造(+50万/企业) | 整机检测项目减少30% |
动态分类调整 | 年度评估报告(+10万/产品) | 降类后注册费节省60% |
命名标准化 | 包装材料更新(+5万/型号) | 市场推广效率提升40% |

2. 实施风险与对策。风险1:频繁调类导致市场混乱。对策:设置每年1次的固定调整窗口期(3月1日-31日)。风险2:零部件追溯增加供应链负担。对策:开发“一码通”系统(UDI与企业ERP直连)。风险3:新技术属性判定滞后。对策:建立专家应急响应组(48小时出具判定意见)。

国际规则协同策略。1.分类命名国际映射
中国类别 | FDA对应类别 | 欧盟MDR分类 | 互认难点 |
Ⅲ类手术机器人 | Class III(PMA) | Class IIb | 欧盟要求人机交互双备份 |
医学影像AI软件 | SaMD Class II | Class IIa | 中美算法验证标准差异 |
合成生物材料 | HCT/P 361产品 | Class III | 细胞活性检测方法不统一 |
2.中国方案输出路径。主导ISO/TC 150工作组:推动手术机器人分类原则成为ISO 13485增补条款。共建GMDN(全球医疗器械术语)中文分支:新增200个中文命名术语。 在IMDRF框架下发布《AI医疗器械动态分类指南》。

关键行动建议。1.发布三大工具包。 医用机器人分类决策树:输入产品参数自动输出分类建议;核心零部件重要度评估表:从技术替代性、故障影响度等维度评分;新技术产品属性自检平台:在线问答生成管理属性预判。2.开展区域试点。长三角:手术机器人命名与分类试点(微创机器人等企业参与);粤港澳:AI医疗器械动态管理试点(腾讯健康、平安科技牵头);京津冀:合成生物材料分类示范(北京干细胞中心承接)。3.建立容错机制。首版命名错误免罚:给予6个月整改期。分类争议快速仲裁:专家委员会7日内裁决。

政策价值:精准分类为创新松绑(如AI软件降类释放研发活力),通过科学命名为产业导航(消除市场推广歧义),最终构建“分类反映技术实质、命名体现临床价值”的医疗器械治理新体系。预计实施后:产品注册分类争议减少70%;核心零部件国产化率提升至50%;新技术上市周期缩短40%。

第三点持续健全标准体系。对该政策文本的深度解析,从战略价值、体系架构、实施难点、创新路径四个维度展开,结合产业实践提出系统性解决方案:政策核心目标解析。
1.三维战略价值
维度 | 具体体现 | 产业痛点 |
技术引领 | 通过标准定义技术路线(如脑机接口电极阻抗≤100Ω) | 创新无序导致研发资源浪费 |
监管提效 | 标准作为审评依据(如AI数据集质量认证免临床验证) | 同类产品重复评价 |
国际竞争 | 中国主导手术机器人ISO标准抢占规则话语权 | 出海遭遇技术性贸易壁垒 |
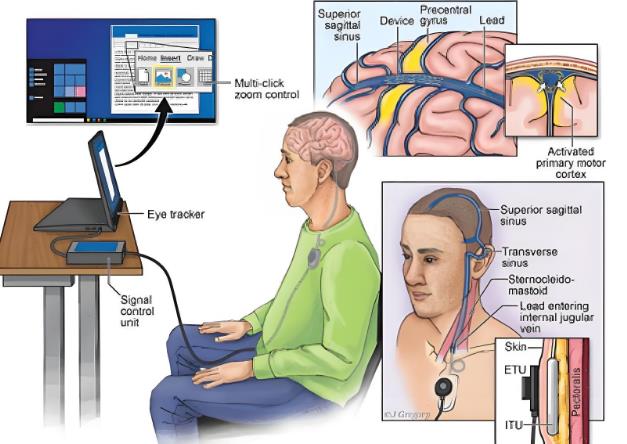
2.重点领域优先级。流程图 A[急需标准] --> A1[医用外骨骼机器人] A --> A2[放射性核素成像设备] B[基础标准] --> B1[医用机器人通用安全] B --> B2[AI医疗器械术语] C[前沿标准] --> C1[脑机接口柔性电极] C --> C2[基因合成生物材料]
标准体系架构设计。1.分层标准框架
层级 | 功能定位 | 代表标准 | 制定主体 |
基础通用层 | 定义术语、安全基线 | 《医用机器人分类与命名》 | 国家标准委 |
方法工具层 | 提供测试评价方法 | 《AI医疗器械算法鲁棒性测试规范》 | 人工智能标技委(筹建) |
产品应用层 | 规定具体产品性能 | 《医用外骨骼机器人步态适配要求》 | 企业联合体主导 |

2.关键标准突破点。医用外骨骼机器人:性能标准:步态识别准确率≥95%、响应延迟≤50ms;安全标准:防跌倒响应时间<0.5秒(参照ISO 13482)。放射性核素成像设备:分辨率标准:PET-CT空间分辨率≤2.5mm(传统为4mm); 剂量控制:单位检查辐射剂量降低30%。AI标准数据集:肺部CT数据集:覆盖10种罕见病+5类人种差异数据;偏见控制:性别/年龄分布符合中国人口普查比例。

实施难点与创新对策。1.技术迭代与标准滞后的矛盾
冲突领域 | 传统模式弊端 | 创新解决方案 |
AI算法持续学习 | 标准锁定旧版本导致“出生即过时” | 动态标准机制:年度更新测试数据集 |
脑机接口材料 | 电极柔性度无量化指标 | 性能分级标准:A级(曲率半径≤1mm) |
3D打印医用材料 | 新材料涌现快于标准制定 | 属性白名单制度:符合基础安全要求先上市,2年内补标 |

2.标准化组织运作创新。医用机器人标技委筹建方案:流程图 企业CTO -- 技术提案 --> 工作组;临床专家 -- 需求输入 --> 工作组;检测机构 -- 方法验证 --> 工作组;工作组 --> 标准草案 --> 快速通道发布。企业投票权重≥40%:确保标准可实施。 90天快速立项:较常规流程压缩60%时间。
3.快速程序实施路径。急需标准“绿色通道”:
阶段 | 时限(根据实际情况改变) | 关键动作 |
立项 | 7日 | 产业联名提案+监管应急确认 |
起草 | 60日 | 复用国际预研成果(如FDA标准草案) |
征求意见 | 15日 | 定向发送头部企业 |
发布 | 3日 | 先行实施后完善 |

前沿标准攻坚策略。1.新型生物材料标准破局
材料类型 | 标准化难点 | 中国方案 |
脑机接口柔性电极 | 体内长期稳定性评价 | 建立加速老化模型(1年≈10年体外) |
基因工程合成材料 | 生物安全性检测方法缺失 | 开发类器官毒性芯片替代动物实验 |
增材制造医用钛合金 | 粉末流动性标准不统一 | 制定球形度≥95%的激光熔覆粉体要求 |

2. AI医疗器械标准创新。数据集建设三原则:临床真实性:>70%数据来自临床实际(非公开数据集);偏见可控性:少数民族样本占比≥8%; 持续更新机制:每季度新增10%病例。
算法测试“压力舱”:
测试类型 | 方法 | 合格阈值 |
对抗攻击 | 加入高斯噪声(SNR=15dB) | 准确率下降≤5% |
数据漂移 | 替换20%测试集来源设备 | AUC波动≤0.03 |

产业影响与实施保障。1.企业合规成本变化
标准类型 | 成本增加项 | 成本节约项 | 净效益 |
外骨骼机器人性能标 | 步态实验室建设(约200万) | 免于重复临床验证(省300万) | +100万/产品 |
AI标准数据集 | 数据采集标注(约50万) | 算法训练效率提升40% | 研发周期缩短6个月 |
脑机接口电极标 | 材料纯度提升(成本+30%) | 国内检测替代欧美认证(省200万) | +170万/产品 |

2.保障体系设计。资金机制:设立标准创新基金(财政拨款+企业捐赠);对主导国际标准企业奖励100万元/项。基础设施:建设三大标准验证中心:
中心 | 核心能力 | 产业链接 |
上海(机器人) | 力反馈精度校准(精度0.01N) | 微创机器人产品迭代 |
深圳(AI) | 算法压力测试平台 | 腾讯觅影系统验证 |
天津(生物材料) | 类器官芯片毒性评估 | 正天生物可降解支架加速 |

国际规则协同路径。1.中国标准国际化三步走。流程A[技术预研] --> B[国内实施] --> C[多边互认] --> D[国际标准]。关键行动:推动医用外骨骼机器人标准纳入ISO 13485增补条款(2026); 在IMDRF框架下主导《AI医疗器械数据集指南》(2025提案);中美共建脑机接口电极生物相容性测试方法(替代ISO 10993)。

2.企业出海标准工具包。一键生成合规报告:输入产品参数→自动输出符合FDA/CE的标准对照表。国际认证直通车:通过中国标准认证的企业,享受欧盟NB机构审查减免。实施建议。1. 发布标准路线图。编制《高端医疗器械标准建设白皮书》,明确2025-2030年优先级(如2025年重点攻关手术机器人精度标准)。2. 开展“标准沙盒”试点。在浦东新区允许10家企业试用草案标准,同步收集问题反馈。3. 建立动态评估机制。对实施满2年的标准进行效力评级(采纳率<60%则启动废止程序)。

终极目标:通过标准体系从“跟随应用”向“创新定义”转型,使中国成为全球高端医疗器械的“规则策源地”。预计到2027年:国产手术机器人因标准优化降低注册成本40%。中国主导的医疗器械国际标准占比从5%提升至25%。脑机接口等前沿领域标准制定领先欧美12个月。

第四点健全沟通指导机制和专家咨询机制。对该政策文本的深度解析,从机制设计、实施难点、创新价值、操作路径四个维度展开系统性分析,并提出具体实施方案:
政策核心要点拆解。1. 全周期沟通机制升级
沟通场景 | 传统痛点 | 新规突破 | 工具支持 |
产品研发阶段 | 审评介入滞后(>12个月) | 前置审评(Pre-R&D介入) | 研审联合实验室 |
临床评价 | 方案设计反复修改 | 临床专家专班指导(72小时反馈) | eCTD系统智能预审 |
体系核查 | 上市前突击整改 | 分阶段检查(设计→试产→量产) | UDI追溯模拟平台 |

2.专家库建设创新方向。流程图 A[专家类型] --> A1[有源设备-手术机器人] A --> A2[医用材料-可降解金属] A --> A3[临床-神经介入] B[遴选机制] --> B1[企业CTO占比≥30%] B --> B2[国际专家库融合] B --> B3[动态考核末位淘汰]。
前置审评机制实施路径。1. 三阶段介入模型
研发阶段 | 审评重点 | 输出成果 | 周期 |
概念设计 | 技术路线合规性预判 | 《关键技术可行性报告》 | ≤15工作日 |
原型开发 | 检测方法有效性验证 | 《检测方案确认书》 | ≤30工作日 |
临床试验前 | 临床终点指标合理性 | 《临床评价策略同意书》 | ≤45工作日 |

2.体系核查前置操作。分阶段检查要点:
阶段 | 检查重点 | 企业收益 |
设计阶段 | 风险管理文档完备性 | 避免后期设计变更损失超500万 |
试产阶段 | 工艺验证方案有效性 | 量产良率提升30% |
量产前 | UDI追溯系统可靠性 | 上市后监管成本降低40% |

专家智力支持长效机制。1. 专家库架构优化
专家类别 | 扩容方向 | 考核指标 | 激励措施 |
技术专家 | 新增脑机接口/3D打印方向 | 方案采纳率≥80% | 优先担任ISO工作组代表 |
临床专家 | 覆盖罕见病诊疗中心 | 临床方案一次通过率 | 科研项目推荐权 |
国际专家 | 引进FDA/EMA前审评员 | 跨境协调案例数 | 开放中国临床试验资源 |

2. 前沿技术支持机制。技术预警响应流程: 学术论文/专利预警 --> 专家委员会评估 --> 制定《技术白皮书》 --> 企业定向推。典型案例:2024年柔性电极技术突破 → 发布《脑机接口植入物加速老化测试指南》 → 帮助企业节省验证时间6个月。

实施难点与创新对策。1. 前置审评资源瓶颈。痛点:专家人力不足(单个手术机器人项目需200小时)。解决方案:数字孪生预审:构建虚拟审评平台,AI自动识别30%基础问题。
分级付费机制:
服务等级 | 响应时效 | 费用 |
加急 | 48小时 | 5万元/次 |
标准 | 15工作日 | 免费 |
2. 企业信任度问题。隐患:担忧提前暴露技术机密。风控设计: 保密协议:法律约定泄密赔偿(≥研发投入的30%)。数据沙箱:企业上传脱敏资料,专家在线分析。

国际经验与中国创新。1. 欧美机制对比。
机制 | FDA | EMA | 中国创新 |
前置沟通 | Pre-Sub会议($4.9万/次) | Scientific Advice(€8万) | 免费预沟通(年省200万) |
专家支持 | 第三方顾问(企业雇佣) | 专家委员会(公益性质) | 公益+企业联合资助 |
体系核查 | 上市后飞行检查 | 文件审查为主 | 分阶段嵌入式检查 |
2. 中国方案输出路径。创建“全球创新器械服务中心”:提供多语言前置审评服务(中/英/法);发展中国家的企业享受费用减免;主导IMDRF前置审评指南:推广“三阶段介入模型”。

产业影响量化预测
政策举措 | 企业效益 | 监管效能提升 |
前置审评 | 研发周期缩短40% | 注册补正率下降70% |
专家库扩容 | 方案采纳率从60%→85% | 国际标准参与度提升3倍 |
体系核查分阶段 | 量产一次性通过率提高50% | 上市后不良事件减少30% |

实施路线图建议。1. 2024年试点突破。在张江科学城设立前置审评中心(覆盖手术机器人、脑机接口)。发布《高端器械专家库管理办法》(明确国际专家引进流程)。2. 2025年机制深化。建成虚拟审评平台(AI处理50%基础咨询)。启动体系核查分阶段试点(首批20家创新企业)。3. 2026年全球输出。在IMDRF框架下发布《前置审评国际指南》 。发展中国家100家企业享受中国审评服务。
创新价值总结:通过“专家前移+检查嵌入”,将监管资源从“上市把关”转向 “创新助推”: 企业端:脑机接口产品研发周期从 5年→3年,节省研发费用超2亿元 ;监管端:高端器械注册退审率从35%→12%;国际端:吸引50家海外企业来华研发,提升中国规则话语权。有机会再讲其他几点。
中新经纬



