

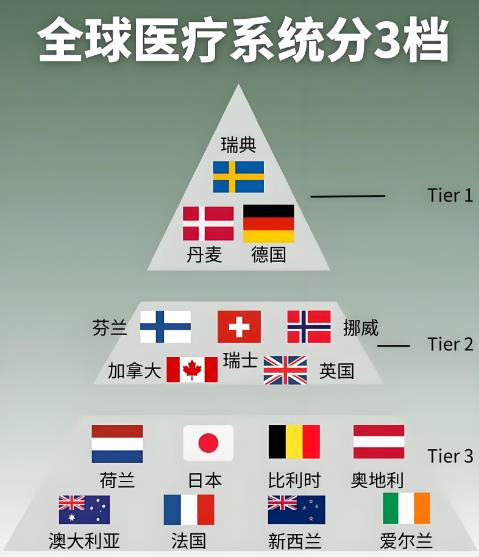
中国与国外医疗认证体系在法规框架、审评标准、流程效率及国际互认等方面存在显著差异。中外医疗差异主要体现在体系结构、服务模式、技术水平和医疗理念等方面。中国的医疗体系以公立医院为主,注重普惠性和广覆盖;西方国家则更多依赖市场化机制或混合体系,强调分工与效率。认证体系与法规框架。中国(NMPA认证)。分类管理:分Ⅰ、Ⅱ、Ⅲ类(风险递增),Ⅲ类器械需国家药监局直接审批,强调符合《医疗器械注册管理办法》及GB国家标准(如GB 9706.1-2020电气安全标准)。监管特点:注重“静态测试”,要求算法“冻结”(任何修改需重新审批),临床样本量要求较低(如多中心试验样本量仅为FDA的1/3)。美国(FDA认证)。风险分级:Class I(低风险)至Class III(高风险),Class III需PMA(预市批准)并提交完整临床数据。动态监管:允许算法迭代(≤15%变更免重审),要求实时性能监控并上传临床数据。欧盟(CE/MDR认证)。分类细化:I、IIa、IIb、III类,高风险产品需公告机构(Notified Body)审核。法规更新:2021年实施MDR,强化临床评价和上市后监管,技术文件要求比原MDD提高30%。

审评流程与时间成本。
认证类型 | 审批时间 | 关键环节 | 案例说明 |
中国NMPA
| Ⅱ类:6–12个月Ⅲ类:12–24个月 | 临床评价+现场检查
| AI医疗设备平均耗时18个月 |
美国FDA
| 510(k):3–6个月PMA:12–24个月 | 等效性证明/完整临床数据 | IBM Watson Oncology耗时28个月获Ⅲ类认证 |
欧盟CE(MDR)
| 6–18个月
| 公告机构审核+临床评估 | 高风险器械因MDR延期增加12个月 |
费用对比:FDA的PMA申请成本超$50万,中国NMPA费用较低但隐性成本高(如重复试验)。

临床验证要求。国际标准:大规模多中心研究(如Mayo Clinic心血管AI系统覆盖17国23万病例,含1.2万罕见病)。前瞻性双盲对照+12个月随访(87%国际顶刊研究采用)。国内现状:样本量小(如某冠心病AI诊断仅8家医院6000例),罕见病例占比<3%。数据质量问题突出:影像采集标准不一(15%病例因设备差异被剔除)、标注不一致(专家分歧率12%)。医院认证体系。1.中国“三甲” vs 国际标准。传统三甲:行政评审导向,侧重硬件配置与规模。新版CIHA认证(中国国际医院标准):融合ISQua国际标准,新增风险管理、医患透明度等要求。案例:香港大学深圳医院通过CIHA,成为保险直付定点(对接友邦、保诚等商业保险)。2.国际标杆(如JCI):以患者安全为核心,覆盖诊疗全流程(如梅奥诊所AI系统实现术中实时导航,误差小于0.5mm)。

国际互认与市场准入。中国局限:NMPA认证尚未与FDA/CE互认,出口需重复认证。仅17%的AI项目提供ROI数据,影响国际商业保险接纳。欧美优势:CE认证通行欧盟27国,FDA认证提升全球认可度。ISO 13485质量管理体系为多国接受(中国亦采用,但执行力度弱于欧美)。总结:核心差异与挑战。技术迭代:FDA允许有限算法更新,中国需“冻结”模型,导致国内AI产品迭代速度比国际慢50%。临床严谨性:国际要求前瞻性大样本研究,国内回顾性数据为主,证据强度不足。医院整合:国际AI已深入治疗决策(如约翰霍普金斯ICU系统医生采纳率83%),国内82%应用集中于影像诊断。国际接轨:中国CIHA认证起步(仅4家医院通过),而JCI曾覆盖国内百余家医院。对中国企业的启示:若目标市场为欧美,需优先满足FDA/MDR的临床与动态监管要求;若立足国内,应关注CIHA认证以打通商保支付,同时优化临床验证设计提升数据质量。

中国医疗器械企业要同时满足中国国家药品监督管理局(NMPA)和美国食品药品监督管理局(FDA)的认证要求,面临多维度的复杂挑战。这些挑战不仅涉及技术和管理层面,还涉及资源分配和战略规划。1. 临床试验设计的差异与数据互认壁垒。样本规模与随访要求。NMPA对高风险器械(如III类)的临床试验样本量要求通常低于FDA(如多中心试验样本量仅为FDA的1/3),且随访周期较短(通常6个月 vs FDA要求的12个月以上)。FDA强调前瞻性、大样本、多中心研究,而NMPA接受部分回顾性数据,导致同一产品需重复开展试验,增加成本和时间。数据质量标准差异。FDA要求原始数据可溯源(如原始影像需保留),而中国部分临床中心数据采集标准不一(15%病例因设备差异被剔除),影响数据国际认可度。

2.质量体系要求的冲突与执行成本。硬件 vs 过程控制。NMPA审核偏重硬件设施(如GMP厂房洁净度),而FDA依据QSR 820(即将修订为QMSR)强调动态过程控制,如CAPA(纠正与预防措施)系统、设计变更追溯等。中国企业常因CAPA流程不完善被FDA警告。算法迭代的监管差异。FDA允许有限算法更新(如≤15%变更免重审),要求实时性能监控;NMPA要求算法“冻结”,任何修改需重新审批,导致产品迭代速度降低50%。

3. 审批流程与时间成本的倍增。时间周期差异
认证类型 | 典型周期 | 关键瓶颈 |
NMPA(III类) | 18-36个月 | 临床评审+现场核查反复补正 |
FDA 510(k) | 3-6个月 | 实质等同性论证耗时 |
FDA PMA | 12-24个月 | 临床数据深度审查 |
企业需并行推进两套流程,总周期可能长达4-5年,且NMPA审评资源紧张导致时间不可预测。

4.监管逻辑与标准的分歧。风险分类错位。同一产品在不同市场分类不同(如血糖仪在NMPA为II类,在FDA为Class II但需510(k),在欧盟为IIa类),需重新准备技术文件。可用性工程要求。FDA要求覆盖全用户(含维修人员),NMPA仅关注医疗操作人员;FDA对关键任务定义更宽泛(如设备设置错误),而NMPA聚焦临床使用场景。5.资源分配与合规成本的高压。直接成本叠加。双重认证总费用可达100-300万人民币(NMPA注册30-80万,FDA 510(k) 15-25万,PMA超200万),且需维持两套质量管理体系(ISO 13485为共同基础,但执行标准不同)。隐性成本与人才缺口。需组建熟悉中美法规的双语团队,合规人才稀缺;因时差和政策变动(如FDA的AI软件新规、中国优先审评政策调整),需动态调整策略。
破局关键点。1.临床试验一体化设计。采用“主方案(Master Protocol)”同步满足双方要求:前瞻性设计+大样本(覆盖中美欧人群)+ 12个月随访,数据分拆提交。2.质量体系融合升级。以ISO 13485为基底,增加FDA要求的CAPA深度(如根本原因分析工具)和NMPA的硬件规范,通过第三方预审降低不合规风险。3.策略性利用政策红利。FDA小企业费用减免(最高75%);中国创新器械优先通道(如AI诊断产品);通过RCEP在东南亚设厂,利用关税减免和CE/FDA互认优势。双重认证的最大挑战是体系性冲突:从临床试验的底层逻辑到质量管理的执行标准,再到监管资源的分配模式,企业需在动态博弈中平衡合规与创新。成功者往往通过“一体化设计+本土化执行”(如FDA主攻、NMPA协同)降低边际成本,将挑战转化为全球化竞争力。

中国CIHA认证与国际JCI认证在评审标准上的关键差异主要体现在设计理念、核心指标、评审方法及国际兼容性等方面。设计理念与架构差异。1.CIHA(中国标准)。本土化融合:以中国《三级医院评审标准》为基础,融合国际医疗质量协会(ISQua)核心要求,强调“三甲标准国际化升级”。例如,在保留国内医疗质量监测指标的同时,新增风险管理、医患透明度等国际条款。政策衔接性:注重与国内医改政策(如公立医院绩效考核、“国考”)协同,避免医院重复应对多套标准。2.JCI(国际标准)。患者中心绝对化:核心围绕“患者安全与权利”,要求医院所有流程(如用药安全、感染控制)均以患者体验为终极目标,弱化硬件规模考核。文化中立性:标准框架需适应各国法律宗教差异,但核心条款(如197项核心标准)全球统一执行。

核心评审标准差异。1.风险管理与应急预案。CIHA:要求建立系统化风险管理框架,覆盖自然灾害(如台风)、公共卫生事件(如传染病爆发)及医疗操作风险,并需定期演练。强调职业安全,将医护人员防护纳入核心指标(如减少职业暴露伤害)。JCI:侧重医疗流程风险(如手术错误、用药差错),要求制定火灾、停电等预案,但较少涉及区域性灾害响应。2.人文关怀与患者权利。CIHA:新增“医患关系坦诚化”条款,要求医院公开诊疗风险并签署知情同意文件,同时提供心理社会支持服务。JCI:强调患者隐私保护(如病历保密、治疗隔离)和教育参与(如治疗方案共同决策),但未强制要求医患风险透明化沟通。

3.医疗质量数据应用。CIHA:要求医院建立智能化质控系统,实时监测DRG(疾病诊断分组)绩效、抗菌药物使用率等国内重点指标,并与国际商业保险公司共享ROI(投资回报率)数据。JCI:注重临床过程质量(如感染率、跌倒发生率),通过PDCA循环持续改进,但较少与支付方数据联动。4.员工资质与流程管理。CIHA:接受国内职称体系,但要求医院建立医生能力分级授权制度(如手术权限动态考核)。JCI:强制要求“各司其职”,禁止医护人员跨岗位操作(如护士不得参与清洁),确保专业分工效率。

评审方法差异。
维度 | CIHA | JCI |
评审周期 | 首次认证后每4年复审(衔接三甲周期) | 每3年复审(防质量滑坡) |
评审流程
| 六组专家3-5天审查,含数据系统实时验证 | 医生/护士/行政官3人小组追踪患者全流程 |
核心工具
| 结合“追踪检查法”+“数据驱动评审” | 纯“循迹追踪法”(跟踪患者就诊路径) |
国际兼容性与商业价值。CIHA:通过ISQua认证(97%得分率),获友邦、保诚等国际保险直付认可,助力医院对接商保支付。支持多院区同步认证(同一法人主体),降低连锁医院评审成本。JCI:全球40余国通用,但中国公立医院因数据安全政策限制已暂停参与(仅剩7家私立医院通过)。

核心差异定位。
差异维度 | CIHA认证 | JCI认证 |
核心理念 | 三甲升级+国际融合 | 患者安全绝对优先 |
数据要求 | 衔接DRG/国考指标 | 临床过程质量监测 |
保险对接 | 打通国内外商保支付 | 国际商保传统通道 |
本土适应性 | 兼容国内政策与职称体系 | 需调整适应本地法规 |

对中国医院的启示:若目标为国际化商保支付与跨境医疗,CIHA更高效(如港大深圳医院同步获三甲与ACHS认证);若服务纯外籍患者,JCI仍具品牌认知优势,但需应对国内政策限制。

2025 年 7 月 30 日,马来西亚医疗器械管理局(MDA)与中国国家药品监督管理局(NMPA)将正式启动医疗器械监管互认计划,这是全球首个此类国际监管合作倡议,标志着两国在医疗器械监管领域的历史性突破。中国与马来西亚在医疗认证(尤其是医疗器械注册)体系上存在显著差异,主要体现在监管框架、审批流程、临床要求及国际兼容性等方面。监管框架与分类体系。1.中国(NMPA)。分类标准:分Ⅰ、Ⅱ、Ⅲ类(风险递增),Ⅲ类高风险器械(如植入式心脏起搏器)需国家药监局直接审批,强调符合《医疗器械注册管理办法》及GB国家标准。质量体系:强制要求GMP(生产质量管理规范)和ISO 13485认证,且需省级药监局现场核查。2.马来西亚(MDA)。分类标准:分A(低风险)、B(中低)、C(中高)、D(高风险)四类,分类规则参考全球协调工作组(GHTF)标准。质量体系:强制要求ISO 13485认证,但无本地GMP核查;分销环节需额外取得GDPMD(良好分销管理规范)认证。

审批流程与时间成本。
要素 | 中国NMPA | 马来西亚MDA |
基础路径
| Ⅱ类:6–12个月;Ⅲ类:12–24个月,需临床评价及现场检查。 | 常规路径:A类30天(行政审核),B/C/D类60–180天(技术评审)。 |
加速通道
| 创新器械优先审评(如AI诊断产品),周期缩短30%。
| 持FDA/CE等认证可走“快速通道”,周期缩短50%;2025年起,持中国NMPA认证的IVD产品可30天极速获批(试点阶段)。 |
互认机制
| 无主动互认机制,需重复注册。
| 认可NMPA、FDA、CE等认证,技术文件可复用。 |
案例:中国核酸扩增分析仪通过NMPA认证后,2025年经马来西亚“验证通道”30天获批,而传统流程需6个月。

技术文件与质量要求。
要求 | 中国NMPA | 马来西亚MDA |
核心文件
| 需提交完整技术文档、临床评价报告(部分需本土临床试验)。 | 采用CSDT模板(通用提交档案),接受海外临床数据。 |
语言要求 | 全中文标签、说明书及技术文件。 | 英文或马来文标签及说明书。 |
体系认证 | ISO 13485 + 中国GMP(双重要求)。 | 仅需ISO 13485,无本地化生产要求。 |

临床试验要求差异。
类型 | 中国NMPA | 马来西亚MDA |
强制范围
| Ⅲ类及部分Ⅱ类器械需本土临床试验(如植入物)。 | 仅高风险(D类)或创新器械需临床试验,接受多国数据。 |
数据来源 | 必须在中国境内开展试验(除少数豁免情形)。 | 接受海外数据(如欧盟、美国),本地化数据非强制。 |
伦理审查 | 需中国伦理委员会批准。 | 遵循ICH-GCP标准,无地域限制。 |
案例:水胶体敷料(IIa类)在马来西亚仅需提供生物相容性报告,而中国若与已上市产品差异显著,可能要求本土临床试验。
本地化与市场准入壁垒。1.本地代理要求。中国:境外企业需指定中国境内注册代理人,承担法律责任。马来西亚:强制指定本地授权代表(AR),需持有MDA许可证及GDPMD证书。2.标签与说明书。中国:全中文标签,含注册证号及生产信息。马来西亚:英文/马来文标签,需标注AR信息及MDA注册号。最新突破:中马互认机制的影响。2025年7月启动的 “中马IVD监管互认” 试点(至9月30日)显著缩小差异:1.中国→马来西亚:NMPA认证的IVD产品可跳过重复临床评估,30天内获马来西亚批准。适用范围:中国省级药监局II类及国家III类IVD证书首次被纳入互认。2.马来西亚→中国:马来西亚IVD产品可通过中国“绿色通道”60天准入市场。战略意义:中国监管标准首获国际全面认可,为东盟其他国家提供范本(如泰国、印尼正在对接)。企业可同步规划中马市场,节省90%合规成本。

核心差异与趋势。
维度 | 中国NMPA认证 | 马来西亚MDA认证 |
监管逻辑 | 本土化强监管(重现场检查与临床) | 国际兼容性高(认可多国数据) |
时间成本 | 长周期(6–24个月) | 短周期(30–180天,互认后更短) |
市场定位 | 独立市场(需完整本土化) | 东盟跳板(辐射新加坡、泰国等) |
趋势演变
| 逐步接轨国际(如eRPS电子申报、UDI追溯) | 主动吸纳多国标准,强化区域枢纽地位 |

企业建议:进军马来西亚:优先获取NMPA认证+ISO 13485,利用互认窗口期快速注册。进入中国:马来西亚企业需准备中文标签及本土临床数据(如需),通过绿色通道降低成本。长期布局:关注东盟单一提交机制,以马来西亚为支点拓展东南亚市场。

中国企业在马来西亚注册医疗器械时,常因不熟悉当地法规框架和操作细节而面临合规挑战。以下从高频问题出发,结合解决方案和最新政策(含2025年中马互认计划),系统梳理关键要点:最常见合规问题及根源分析。1.产品分类错误与本地化适配不足。问题:误判马来西亚的A-D类风险分级(如将中国Ⅱ类器械错归为马来西亚B类,实际应为C类);未适配本地需求(如热带气候对器械材料的影响、马来语标签缺失)。后果:注册被驳回或需重新提交,延误3–6个月。2. 授权代表(AR)管理不当。问题:选择无GDPMD(良好分销管理规范)证书的代理,或授权范围模糊;AR未提前参与文件预审,导致清关时资料与注册信息不符。后果:注册申请被拒,或物流延迟引发医院违约索赔。

3.技术文件与语言合规缺陷。问题:核心文件缺失(如生物相容性报告、马来语说明书);依赖中文版ISO 13485证书,未提供英文/马来文版本。后果:MDA要求补件,延长审批周期。4.质量体系执行脱节。问题:ISO 13485认证与实际生产脱节(如设计变更未同步更新文件);未建立本地售后追踪体系(如不良事件报告缺失)。后果:MDA现场审核不通过,注册证无法续期。

针对性解决方案与实操策略。1.精准分类与本地化设计。解决方案:双轨对照:同步对比中国NMPA分类与马来西亚A-D类标准(如参考GHTF指南),优先通过马来西亚本地律所或注册代理确认;气候适配:对热带地区高需产品(如敷料、导管),增加防霉变、耐高温测试报告。2.优化授权代表(AR)管理。解决方案:资质核验:要求AR提供MDA许可证编号及GDPMD证书,并核查历史案例协同预审:注册阶段即让AR介入文件预审与标签翻译(如使用沃世国际等专业机构的马来语模板)。3.技术文件一体化提效。解决方案:复用互认政策:2025年7月30日起,持NMPA证书的企业可通过 “验证通道”30天极速获批,仅需补充英文版ISO 13485及CSDT(通用提交档案)模板文件。语言合规:委托马来西亚本地翻译公司处理标签与说明书(需含警示标识、生产批号)

3.质量体系动态衔接。解决方案:内审前置:每季度比对ISO 13485执行记录与注册文件,确保设计变更同步更新;建立本地追溯链:要求AR承担售后监管(如不良事件24小时内报MDA)。中马互认新政(2025)的杠杆式应用。政策红利。时间节省:传统流程需6–24个月,互认后缩短至30天;成本降低:免重复临床试验,文件复用率超90%,节省费用约30%。操作要点。适用产品:首批覆盖IVD(如核酸试剂)、影像设备(MRI、超声)、心血管器械等中国优势品类;关键动作:确认产品持有有效NMPA证书;提交英文版ISO 13485及CSDT文件;通过MDA官网提交电子申请。

风险规避与长效合规。
问题类型 | 规避策略 | 新政增益(2025) |
分类错误 | 双轨对照+本地代理确认 | 互认后分类争议减少 |
AR管理缺陷 | 核验GDPMD资质+协同预审 | AR可快速处理互认文件 |
文件缺陷 | 复用NMPA材料+专业翻译 | 30天通道免重复提交 |
质量体系脱节 | 内审前置+AR追溯 | ISO 13485为唯一强制体系认证 |

行动建议:短期:优先选择已通过互认政策落地的品类(如IVD),利用30天窗口期快速准入;长期:在马来西亚设立合规中心,辐射东盟市场(如泰国、印尼正推进类似互认)。资源整合:与沃世国际等专业物流服务商合作,实现“注册-清关-配送”全链路合规。

根据2025年7月30日启动的中马医疗器械监管互认试点政策(有效期至2025年9月30日),中国医疗器械企业可通过“验证通道”在30天内获得马来西亚市场准入资格。以下是可享受快速通道的具体产品范围、要求及限制。政策覆盖的核心产品。1.体外诊断(IVD)产品全品类。核酸扩增分析仪:如PCR检测设备、基因测序仪等分子诊断设备,是当前中国对马来西亚出口的主力产品。免疫诊断设备及试剂:包括化学发光分析仪、酶联免疫试剂盒、POCT(即时检测)设备。生化诊断设备:如全自动生化分析仪及配套试剂。其他IVD产品:血糖仪、血细胞分析仪、微生物培养系统等。案例:华大基因的肠癌早筛产品COLOTECT 1.0(基于粪便DNA检测)已通过传统流程进入马来西亚市场,同类产品现可走快速通道。

2.部分高端医疗设备(需符合互认条件)。影像设备:超声设备、MRI(核磁共振成像仪)等,但CT、PET-CT等仍以传统国际品牌为主导。监护类设备:如多参数监护仪、远程心电监测仪。认证资质。1.中国认证类型。省级药监局审批的II类IVD注册证(首次被纳入国际互认范围),国家药监局(NMPA)审批的III类IVD注册证。2.质量体系认证。必须提供ISO 13485证书(英文版),其他如FDA的QSR、日本MHLW认证可作为补充材料。关键突破:此前马来西亚仅认可欧美日澳等发达经济体的认证,此次是中国省级II类证书首次获国际互认。

政策限制与除外产品。1.不适用快速通道的产品。非IVD医疗器械:如心血管支架、骨科植入物、手术器械、医用敷料等(试点阶段仅限IVD)。创新器械未获NMPA认证者:即使属于IVD领域,若未取得中国注册证,仍需走传统审批流程。2.文件要求。需提交CSDT技术文档(含风险分析、临床性能数据等),且标签说明书需为英文或马来文。企业操作要点与战略建议。1.窗口期利用。试点仅2个月(2025.7.30–9.30),早提交享“先到先审”优势,逾期政策可能调整。2.本地代理强制要求。必须指定持有MDA许可证+GDPMD证书的马来西亚授权代表(AR),由其提交申请并负责售后监管。3.成本与时间收益。节省90%合规成本:免重复临床和检测,文件复用率超90%。同步布局销售渠道:30天审批期内可提前对接经销商,加速商业化。

拓展东南亚市场的战略价值。1.马来西亚的枢纽地位。MDA认证受泰国、印尼等国认可,企业可借此跳板布局东盟近7亿人口市场。2.国产替代机遇。马来西亚IVD市场长期被西门子、雅培等垄断,中国性价比产品(如迈瑞的POCT设备)有望快速抢占份额。3.政策延伸预期。若试点成功,2026年可能扩展至心血管介入、家用医疗设备等品类。

行动指南。
维度 | 关键要求/策略 |
适用产品 | IVD全品类(省级II类+NMPA III类认证) |
核心限制 | 非IVD器械、无中国认证产品除外 |
时间窗口 | 2025.9.30前提交,优先选择出口主力产品(如核酸分析仪、POCT设备) |
必备资源 | 英文ISO 13485证书、马来语标签、合规AR代理 |
长期布局 | 以马来西亚为支点,通过东盟互认网络覆盖泰国、印尼市场 |

企业优先动作:筛选已获NMPA认证的IVD产品,尤其是省级II类证书持有者;联系马来西亚持证AR(如沃世国际)准备CSDT文件包;在MDA官网提交电子申请,抢占“30天通道”红利期。
在马来西亚医疗器械注册中,授权代表(Authorized Representative, AR)是外国制造商进入当地市场的法定桥梁,其选择直接影响注册效率与长期合规性。以下是AR的选择标准及资质评估方法,结合法规要求与实操经验综合说明。核心选择标准。1.法定资质(强制)。法律实体:AR必须是马来西亚注册的公司或合法机构,持有有效的商业登记证明(SSM注册。许可证与认证。MDA场所许可证(根据第737号法案颁发)。GDPMD证书(医疗器械良好分销规范),证明具备合规仓储和分销能力。

2.专业能力。法规经验:需熟悉马来西亚《医疗器械管理法(2012)》及东盟互认机制(如中马互认试点政策),能快速处理技术文件(如CSDT模板)。技术理解力:具备医疗器械专业知识,能审核临床报告、风险管理文件,并应对MDA技术质询。历史案例:成功注册同类产品(如IVD、影像设备)的案例库,尤其是B/C/D类高风险产品经验。3.沟通与响应效率。MDA沟通渠道:需有直接对接MDA评审部门的固定联络人,缩短补正周期。多语言支持:提供英文/马来文文件翻译服务,确保标签、说明书合规。

资质可靠性评估方法。1.文件核验。验证三证:商业登记证(SSM),MDA场所许可证编号,GDPMD证书有效期。操作建议:要求AR提供证书原件,并通过MDA官网验证许可证状态。2.能力审计。案例审查:要求提供近2年注册成功的产品清单,重点:是否覆盖目标产品分类(如D类植入;处理发补问题的平均时长(理想值≤30天);模拟测试:提供技术文件样本,测试AR的CSDT文档整理能力及风险分析深度。3.行业口碑调研。客户评价:联系其服务过的制造商(尤其是中资企业),不良事件报告及时性(是否满足MDA要求的24小时内上;应对飞行检查的配合度。合规记录:核查是否曾被MDA处罚或暂停资质(可通过马来西亚医疗器械协会查询)。

高风险选择误区规避
误区 | 风险后果 | 规避策略 |
选经销商兼任AR | 重销售轻合规,延误注册更新 | 选择独立AR机构(如普瑞纯证) |
轻信低价代理 | 隐瞒补正要求,导致注册失败 | 对比服务明细(含隐性成本) |
忽略GDPMD认证 | 仓储不合规,产品被扣留 | 现场考察仓库温控与追溯系 |

合同条款关键点。在授权协议中必须明确:责任范围:AR需承担不良事件报告、飞行检查陪同、证书续期等全周期责任;退出机制:约定更换AR的触发条件(如连续2次未按时处理MDA质询)及数据移交流程;费用结构:拒绝全包报价,要求分阶段付费(如签约付30%,获证付尾款)。AR评估优先级清单。资质硬门槛:GDPMD + MDA许可证 + 商业注册证 → 一票否决项;经验匹配度:同类产品成功案例 >语言能力 >大于响应速度;风控能力:不良事件处理记录>仓库审计报告> 客户推荐信;成本合理性:拒绝低价陷阱,按结果分阶段支付。操作建议:优先选择服务过中马互认试点产品(如IVD)的AR,可复用其政策经验加速注册。



